Nat Commun:胎盘衍生因子促进人iPSC肝脏类器官生长
来源:肠道类器官 2025-04-06 14:18
本研究揭示了缺氧条件下胎盘衍生因子处理是高效诱导祖细胞扩增的关键类器官培养技术。


技术路线图
科学背景与研究现状
在再生医学领域,人诱导多能干细胞(human induced pluripotent stem cells, hiPSC)衍生的类器官因其能够模拟器官发育与疾病过程而备受关注。然而,当前技术瓶颈在于类器官的尺寸限制(通常 < 500 μm)和功能成熟度不足,其核心障碍是祖细胞(progenitor cells)的扩增效率低下。传统培养策略多依赖单一生长因子(如 FGF、WNT)或静态微环境调控,但无法完全复现体内器官发育的时空特异性调控网络。
胎盘作为胎儿发育的核心调控枢纽,通过血液循环向胎儿器官输送营养物质、氧气及生物活性分子。已有研究证实,胎盘功能异常(如胎盘发育不良或血流不足)与胎儿生长受限(fetal growth restriction, FGR)密切相关,但其调控胎儿器官祖细胞扩增的分子机制仍存在重大空白。例如,胎盘分泌的胰岛素样生长因子 1(insulin-like growth factor 1, IGF1)和超氧化物歧化酶 3(superoxide dismutase 3, SOD3)被报道可促进肝脏代谢功能,但这些因子如何协同其他胎盘衍生因子发挥作用尚不明确。此外,胎儿器官在发育早期经历的短暂缺氧(hypoxia)环境(如肝母细胞扩张期的低氧分压)如何与胎盘因子互作,仍是亟待解决的关键科学问题。
现有研究存在三方面挑战:(1)胎盘 - 胎儿器官互作的动态时空特征缺乏系统解析;(2)缺氧微环境与胎盘因子的协同调控机制尚未阐明;(3)hiPSC 类器官培养中祖细胞的 "干性维持 - 分化平衡" 难以精准调控。本研究针对这些空白,创新性地提出胎盘衍生因子在缺氧微环境中通过特定信号通路促进祖细胞扩增的科学假设,并通过多维度实验验证了其机制与应用价值。
关键实验技术与方法
一、类器官培养与调控技术
1. hiPSC - 肝脏类器官构建
-
分化体系:
-
EC 通过 VEGF(50 ng/mL)和 bFGF(10 ng/mL)诱导,MC 通过 PDGF-AA(10 ng/mL)和 TGFβ1(5 ng/mL)分化。
-
采用 3D 悬浮培养法,将 HE、EC、MC 以 1:1:1 比例混合,在超低吸附板中形成类器官球体。
-
hiPSC(Ff01 细胞系)在 Laminin 511 E8 包被的培养皿中,使用 StemFit AK02N 培养基维持。
-
通过 Activin A(100 ng/mL)和 BMP4(20 ng/mL)诱导内胚层分化,后续添加 FGF2(20 ng/mL)、HGF(20 ng/mL)和 Oncostatin M(20 ng/mL)促进肝祖细胞成熟。
-
肝祖细胞(HE)分化
-
内皮细胞(EC)与间充质细胞(MC)共培养
- 3D 培养与刺激:
-
缺氧预处理:类器官嵌入 Collagen/Matrigel(1:1)凝胶,置于 37℃、5% CO₂、1-5% O₂的低氧培养箱中培养 7 天。
-
胎盘因子刺激:添加重组人 IL1α(20 ng/mL)或对照因子(FGF2、IL13 等),每 2 天换液。
-
氧合处理:7 天后转移至常氧(21% O₂)或高氧(40% O₂)环境继续培养 7 天。
2. 类器官功能检测
-
免疫荧光染色:
-
类器官固定于 4% PFA,经 CHAPS/NMDEA 通透处理后,使用抗 HNF4α(1:100,Abcam)、Ki67(1:200,BD Biosciences)和 ALB(1:200,Dako)抗体染色,DAPI 复染细胞核。
-
3D 成像采用 Leica SP8 confocal 显微镜,结合 Imaris 软件进行体积重建与定量分析。
-
分泌功能检测:
-
ELISA 法检测培养上清中的人白蛋白(hALB)水平(Human Albumin ELISA Kit,Abcam)。
-
祖细胞活性验证:
-
类器官消化为单细胞后,进行 Matrigel 克隆形成实验。统计 Kusabira-Orange 标记的 HE 克隆面积(>100 μm² 为有效克隆)。
二、小鼠胚胎研究技术
1. 胎盘血流可视化
-
活体灌注实验:
-
孕鼠麻醉后,通过显微操作向脐静脉注射 Alexa647 标记的抗 CD31 抗体(1:5 稀释,Biolegend),荧光显微镜下观察胚胎血管分布。
-
缺氧区域检测:
-
孕鼠腹腔注射 Pimonidazole(Hypoxyprobe:trade_mark:,60 mg/kg),2 小时后取材,通过抗 Pimonidazole 抗体(1:200,Hypoxyprobe)免疫染色定位缺氧区域。
2. 胎盘因子干预实验
-
IL1α 信号阻断:
-
孕鼠腹腔注射 IL1 受体拮抗剂(IL1RA,10 mg/kg),24 小时后分析胎肝体积及 Ki67 阳性细胞比例。
-
胎盘 - 肝脏共培养:
-
分离 E10.5 胎肝与胎盘,在 Matrigel 中进行接触式培养,添加 Nidanilimab(抗 IL1RAP 抗体,10 μg/mL)阻断 IL1α 信号。
三、分子机制解析技术
1. 单细胞 RNA 测序(scRNA-seq)
-
数据来源:
-
分析小鼠胎肝(E9.5-E11.5)和 hiPSC 类器官的 scRNA-seq 数据(GSE87038、CNP0000236)。
-
关键发现:
-
鉴定 IL1RAP 在间充质细胞中的特异性表达,揭示 IL1α 通过 SAA1-TLR2-CCL20-CCR6 通路激活炎症反应。
2. 通路富集分析
-
微阵列数据整合:
-
结合小鼠胎盘(GSE100053)和胎肝(GSE106465)的基因表达谱,通过 KEGG 通路分析筛选差异基因。
-
IPA 信号通路预测:
-
使用 Ingenuity Pathway Analysis 软件解析 IL1α 处理后 HE、EC、MC 的差异表达基因,构建 SAA1-CCL20 调控网络。
四、技术创新与难点
1. 类器官动态调控策略
-
时空特异性刺激:通过低氧预处理(模拟 E10.5 胎肝环境)与胎盘因子(IL1α)的序贯添加,突破传统静态培养限制。
-
3D 成像定量:利用 Imaris 软件对 HNF4α⁺区域进行体积计算,精确评估类器官生长效率。
2. 胎盘因子验证体系
-
体内外联合验证:通过胎肝离体培养、胎盘共培养及 IL1RA 干预实验,证实 IL1α 的胎盘特异性作用。
科普补充:
-
缺氧培养:低氧环境(1-5% O₂)通过抑制氧化磷酸化,激活 HIF 通路,促进祖细胞干性维持。
-
3D 成像:Imaris 软件通过表面渲染算法,将二维切片重构为三维模型,实现类器官体积的精确测量。
技术流程图:
hiPSC → 三系分化 → 类器官球体 → 缺氧 + IL1α 刺激 → 3D 功能检测 → 机制解析
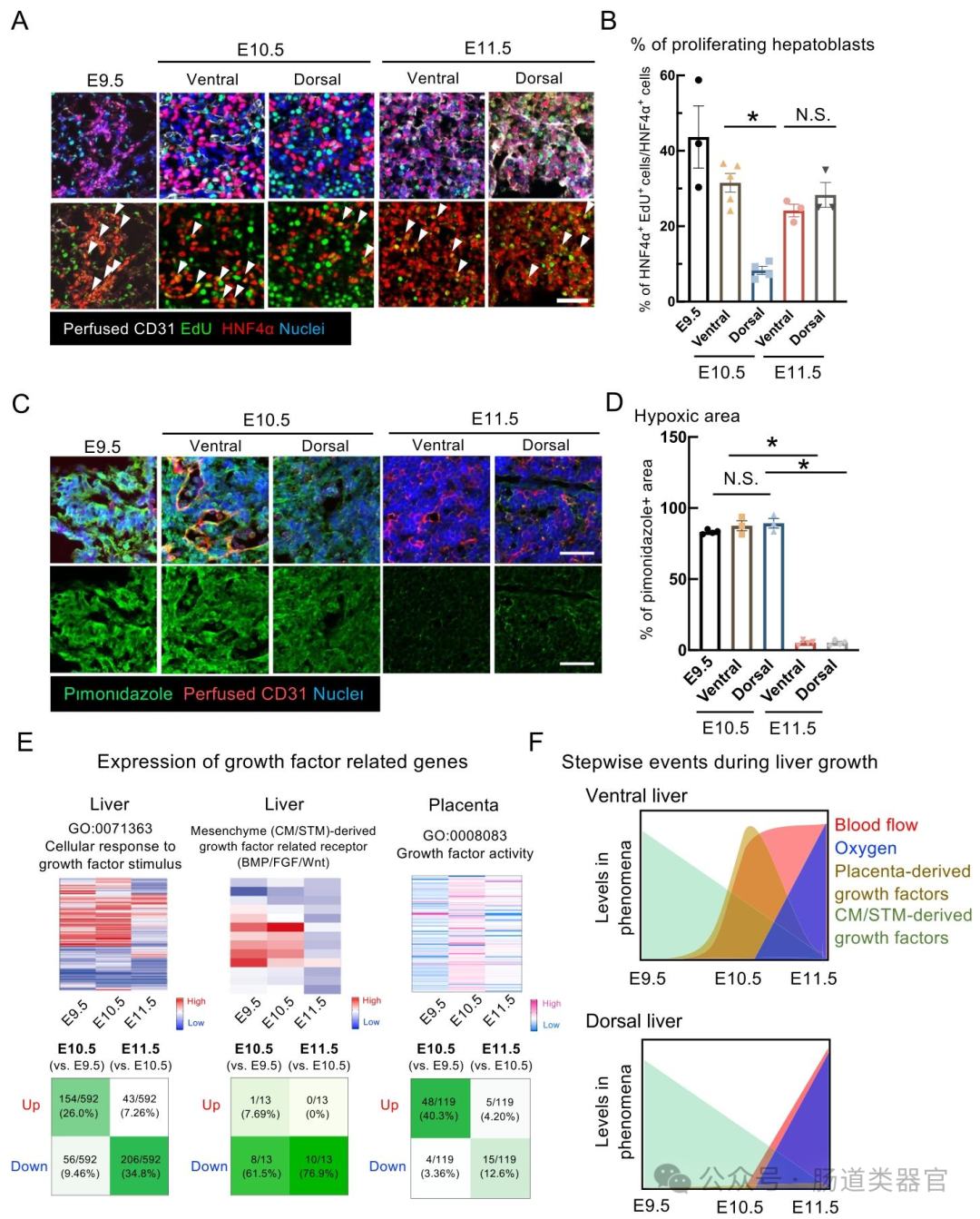
研究团队针对人诱导多能干细胞(hiPSC)肝脏类器官因祖细胞扩增不足导致的尺寸与功能限制问题,提出胎盘衍生因子在特定时空微环境中调控祖细胞扩张的科学假说。研究通过三维成像技术发现,小鼠胚胎肝在E10.5阶段经历短暂缺氧期(图1D),此时胎盘特异性分泌IL1α(图3G)。为验证这一机制,研究采用体内外联合实验:在胎肝离体培养中,添加IL1α使肝实质面积增加2.3倍(图3F);在hiPSC类器官中,缺氧条件下IL1α处理7天可使HNF4α⁺区域体积增大4.8倍(图4B)。机制研究显示,IL1α通过激活间充质细胞的SAA1-TLR2-CCL20-CCR6通路(图4K),促进肝祖细胞增殖。值得注意的是,序贯氧合处理进一步提升类器官功能,ALB分泌量较对照组增加3.2倍(图5D)。该研究首次揭示胎盘-肝脏互作的关键调控因子,并建立"缺氧预处理+胎盘因子刺激"的新型培养策略,为功能性类器官构建提供范式。然而,胎盘因子的时空特异性递送机制、多因子协同效应以及长期培养中的代谢调控仍需深入探索。未来可结合微流控芯片技术(图5A),模拟胎儿血流环境,系统解析胎盘因子与机械应力的动态互作。

特色与创新之处
这项研究的特色与创新之处体现在以下方面:
-
首次揭示胎盘 - 肝脏互作的时空特异性调控机制
研究通过三维血流可视化技术发现,小鼠胚胎肝在 E10.5 阶段经历短暂缺氧期(图 1D),此时胎盘特异性分泌 IL1α(图 3G),形成 "缺氧环境 - 胎盘因子" 的协同调控模式。该发现突破了传统认为血流灌注直接伴随氧合的认知,揭示了胎儿器官发育的关键窗口期。
-
建立 "缺氧预处理 + 胎盘因子刺激" 的类器官培养新范式
通过模拟 E10.5 胎肝的低氧(1-5% O₂)微环境,结合 IL1α(20 ng/mL)刺激,使 hiPSC 肝脏类器官体积扩大 4.8 倍(图 4B),ALB 分泌量提升 3.2 倍(图 5D)。该策略突破了传统静态培养模式,将发育时空特异性与细胞信号整合,为类器官规模化培养提供新方案。
-
发现 IL1α 作为胎盘源性祖细胞扩张因子的新功能
研究证实 IL1α 通过激活间充质细胞的 SAA1-TLR2-CCL20-CCR6 通路(图 4K),促进肝祖细胞增殖。这一机制的阐明,不仅拓展了 IL1 家族在器官发育中的作用,更为炎症信号通路参与组织再生提供了新证据。
-
构建多维度验证体系
通过胎肝离体培养(图 3E-F)、胎盘共培养(补充图 7A-B)、IL1RA 体内干预(图 3L-M)及单细胞测序(补充图 6A-B)等技术,系统验证了 IL1α 的胎盘特异性作用及靶细胞类型,形成从分子机制到功能表型的完整证据链。
-
提出序贯氧合的功能提升策略
发现 IL1α 预处理后的祖细胞在 40% O₂条件下,可进一步促进 ALB⁺细胞成熟(图 5E),揭示了氧合时机对类器官功能成熟的关键影响,为优化类器官代谢微环境提供理论依据。
这些创新点共同构建了胎盘因子调控器官发育的新理论框架,为再生医学领域解决类器官功能性不足的核心难题提供了极具启发性的研究范式。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


